Frequently Asked Questions: Inactivated Influenza Vaccine vs. Nasal Spray (FluMist®)
🌈About the InactivatedInfluenza HA Vaccine
Efficacy and Safety of the Influenza HA Vaccine in Children(Click here for details)
🟠 Number of Doses, Interval, and Timing
Recommended Doses
- Children aged 6 months or older but under 3 years: 0.25 mL × 2 doses (2–4 week interval)
- Children aged 3 years or older but under 13 years: 0.5 mL × 2 doses (2–4 week interval)
- Individuals aged 13 years or older: 0.5 mL × 1 dose
※Premature infants are also assessed based on chronological age. If the child turns 3 between doses, the first dose may be 0.25 mL and the second dose 0.5 mL
🟠 Safety
- The incidence rate of adverse reactions tends to increase with age (e.g., 13.58% in children aged 6 months to under 1 year; 49.69% in children aged 3 years to under 6 years)
- The main adverse reactions are swelling at the injection site and fever (fever occurs in 3.67% overall)
- No serious adverse reactions have been reported
🟠実際の有効率(症例対照研究より)
・6歳未満児:1回接種33~57%、2回接種41~63%(B型は2回接種で有意)
・3歳未満児:1回接種73~83%(2018/2019~2019/2020)
・A型(H1N1)流行時:効果約60%、A型(H3N2)流行時:約40%、B型:約35%
・2013/2014~2019/2020まとめ:A型全体44%、H1N1型63%、B型37%
・6カ月~1歳未満児:一部シーズンで有意な効果(A型36%)
・基礎疾患や免疫抑制状態では効果が減弱する可能性あり
🟠その他の留意点
・卵馴化による抗原性変化の課題は改善傾向
・流行株とワクチン株が一致した場合は高い効果
・乳幼児は重症化しやすく、ワクチンは重症化・死亡予防に一定の効果あり
・集団免疫効果の観点からも接種が重要
・生後6カ月未満児には接種不可だが、妊婦への接種により出生後約6カ月までの児にも免疫効果が期待される
🟠熱性けいれんのある児への接種
・日本小児神経学会は「現行の予防接種はすべて行って差し支えない」としつつ、保護者への十分な説明と、発熱・けいれん時の対応指導が必要としています
文献
1)Bonhoeffer J, et al.: Arch Dis Child. 91(11): 929-935, 2006.
2)The European Agency for the Evaluation of Medicinal Products: Harmonisation of requirements for influenza vaccines. CPMP/BWP/214/96, March 1997. https://www.ema.europa.eu/en/documents/scientific-guideline/note-guidance-harmonisation-requirements-influenza-vaccines_en.pdf
3)独立行政法人 医薬品医療機器総合機構: 審議結果報告書(平成23年8月2日). https://www.pmda.go.jp/drugs/2011/P201100137/47003800_16100EZZ01207_A100_1.pdf
4)Grohskopf LA, et al.: MMWR Recomm Rep. 72(2): 1-25, 2023. https://www.cdc.gov/mmwr/volumes/72/rr/pdfs/rr7202a1-H.pdf
5)デンカ生研株式会社: インフルエンザHAワクチン「生研」特定使用成績調査 集計結果のお知らせ. 2013年8月
6)福島若葉, 他:IASR. Vol. 40 p.194-195: 2019年11月号.https://www.niid.go.jp/niid/ja/typhi-m/iasr-reference/2471-related-articles/related-articles-477/9236-477r07.html
7)Shinjoh M, et al.: Vaccine. 37(30): 4047-4054, 2019.
8)福島若葉, 他:IASR. Vol. 42 p.255-257: 2021年11月号. https://www.niid.go.jp/niid/ja/typhi-m/iasr-reference/2545-related-articles/related-articles-501/10787-501r06.html
9)Shinjoh M, et al.: PLoS One. 10(8): e0136539, 2015.
10)Sugaya N, et al.: Euro Surveill. 21(42): 30377, 2016.
11)Sugaya N, et al.: Vaccine. 36(8): 1063-1071, 2018.
12)Shinjoh M, et al.: Vaccine. 36(37): 5510-5518, 2018.
13)Shinjoh M, et al.: PLoS One. 16(3): e0249005, 2021.
14)Shinjoh M, et al.: Vaccine. 40(22): 3018-3026, 2022.
15)Shinjoh M, et al.: Vaccine. 41(33): 4777-4781, 2023.
16)CDC: MMWR Recomm Rep. 62(RR-07): 1-43, 2013.
17)Kishida N, et al.: Clin Vaccine Immunol. 19(6): 897-908, 2012.
18)CDC: Preliminary Flu Vaccine Effectiveness (VE) Data for 2023-2024. https://www.cdc.gov/flu/vaccines-work/2023-2024.html
19)Maurel M, et al.: Euro Surveill. 29(8): 2400089. 2024.
20)国立感染症研究所: インフルエンザウイルス流行株 抗原性解析と遺伝子系統樹. https://www.niid.go.jp/niid/ja/flu-antigen-phylogeny.html
21)厚生労働省: 令和5年度インフルエンザQ&A. https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/kenkou/kekkaku-kansenshou/infulenza/QA2023.html
22)Flannery B, et al.: Pediatrics. 139(5): e20164244, 2017.
23)Takeda S, et al.: J Infect Chemother. 21(4): 238-246, 2015.
24)予防接種ガイドライン等検討委員会: 予防接種ガイドライン2024年度版. 公益財団法人予防接種リサーチセンター. 2024.
25)日本小児神経学会 監修: 熱性けいれん(熱性発作)診療ガイドライン2023. 診断と治療社.
🔄Influenza HA Vaccine: Dosage, Interval, and Recommended Timing
Recommended Number of Doses
- Individuals aged 13 to under 65 years, and those aged 65 years or older: typically receive one dose
- Individuals with significantly suppressed immune function may receive two doses at the physician’s discretion
Interval Between Two Doses
- Premature infants are vaccinated based on chronological age.
- Children under 13 years of age typically receive two doses spaced 2 to 4 weeks apart.
• - A 3 to 4 week interval is preferablefor effective immune acquisition
- The main adverse reactions are swelling at the injection site and fever; no serious adverse reactions have been reported.
- Infants and young children are at high risk of severe influenza, so vaccination is effective in preventing serious illness
- Infants under 6 months of age cannot be vaccinated.Vaccination during pregnancy is expected to confer immunity to the newborn.
- Children with febrile seizures can also be vaccinated.
Interval and Timing for Two-Dose Influenza HA Vaccination (Click to view)(Click here for details)
- According to the American Academy of Pediatrics (AAP),children receiving the influenza HA vaccine for the first timeare recommended to receive two doses,spaced at least 4 weeks apart.
- A 4-day grace period is permitted, meaning the second dose may be considered valid if administered 25 days after the first dose (i.e., 3 weeks + 4 days)
• Japan’s Recommendations and Practical Approach
• In Japan,two doses of the influenza HA vaccine are recommended at an interval of 2 to 4 weeks.Administration 2 weeks after the first dose is widely practiced and accepted in clinical settings.
- In contrast, the American Academy of Pediatrics (AAP) recommends a minimum 4-week interval to optimize immune response.
This longer interval is intended to maximize immune priming and booster effects, enhancing both antibody production and clinical protection.
- Multiple clinical studies in Japan have shown that vaccination at 2- to 4-week intervals is effective, and there is no evidence of reduced efficacy when the second dose is given after 2 weeks.
- These recommendations are based on Japan-specific immunogenicity data and real-world effectiveness, supporting the validity of the 2-week interval in the Japanese context.
- Japan does not specify a strict “latest possible date” for vaccination.Instead, the primary goal is to complete vaccinationbefore the onset of the influenza season.
1. Recommendations for Prevention and Control of Influenza in Children, 2023-2024. Pediatrics. 2023;152(4):e2023063772. doi:10.1542/peds.2023-063772.
2. Recommendations for Prevention and Control of Influenza in Children, 2024-2025: Policy Statement. Pediatrics. 2024;154(4):e2024068507. doi:10.1542/peds.2024-068507.
Practice Guideline New Research
3. Effectiveness of Inactivated Influenza Vaccine in Children by Vaccine Dose, 2013-18. Shinjoh M, Sugaya N, Furuichi M, et al.
Vaccine. 2019;37(30):4047-4054. doi:10.1016/j.vaccine.2019.05.090.
4. Effectiveness of Influenza Vaccination Among Children in Satellite Cities of a Metropolitan Area in Tokyo, Japan During the 2014/2015-2018/2019 Season. Matsuda A, Asayama K, Obara T, Yagi N, Ohkubo T.
The Tohoku Journal of Experimental Medicine. 2022;258(1):69-78. doi:10.1620/tjem.2022.J057.
5. Influenza Vaccination in Japanese Children, 2024/25: Effectiveness of Inactivated Vaccine and Limited Use of Newly Introduced Live-Attenuated Vaccine. Shinjoh M, Tamura K, Yamaguchi Y, et al.Vaccine. 2025;61:127429. doi:10.1016/j.vaccine.2025.127429.
6.2023–2024年 小児におけるインフルエンザ予防と対策に関する推奨
Pediatrics. 2023;152(4):e2023063772. doi:10.1542/peds.2023-063772.
7.2024–2025年 小児におけるインフルエンザ予防と対策に関する政策声明
Pediatrics. 2024;154(4):e2024068507. doi:10.1542/peds.2024-068507.
8.2013〜2018年における小児のインフルエンザワクチン接種回数別の有効性
Shinjoh M, Sugaya N, Furuichi M, et al.
Vaccine. 2019;37(30):4047–4054. doi:10.1016/j.vaccine.2019.05.090.
9.東京都近郊の衛星都市における小児のインフルエンザワクチンの有効性(2014/15〜2018/19)
Matsuda A, Asayama K, Obara T, et al.
Tohoku J Exp Med. 2022;258(1):69–78. doi:10.1620/tjem.2022.J057.
10.2024/25年 日本の小児におけるインフルエンザワクチンの有効性と新規導入された生ワクチンの限定使用
Shinjoh M, Tamura K, Yamaguchi Y, et al.
Vaccine. 2025;61:127429. doi:10.1016/j.vaccine.2025.127429.
Q:Vaccine Spacing and Co-administration
A: Since October 2020, there are no longer any required intervals between the influenza HA vaccine and other vaccines in Japan.
- As of July 2022, this also applies to the COVID-19 vaccine, making co-administration with the influenza vaccine possible.
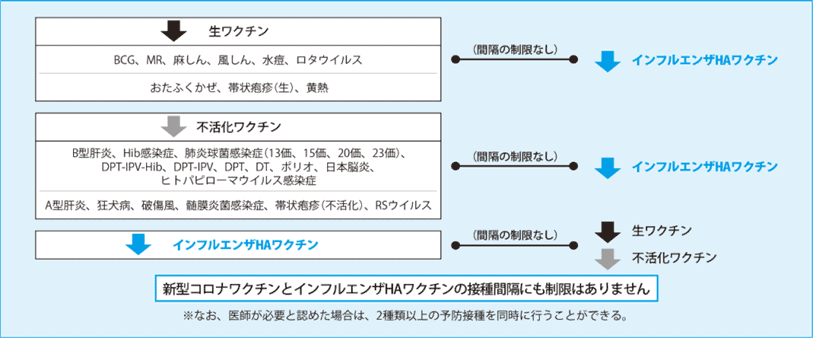
文献(Click here for details)
1)厚生労働省: ワクチンの接種間隔の規定変更に関するお知らせ.
(アクセス2024年3月29日現在)
2)厚生労働省: 新型コロナウイルスワクチンQ&A.
(アクセス2024年4月4日現在)
Onset and Duration of Influenza Vaccine Effectiveness
🟠 Onset of Effectiveness
Immune protection begins approximately 2 weeks after vaccination, with antibody levels reaching protective thresholds around day 14.
🟠 Peak Effectiveness
The vaccine reaches its peak efficacy between 2 to 4 weeks post-vaccination.
🟠 Duration of Protection
In general, effectiveness is maintained for 5 to 6 months. However, the rate of decline may vary depending on virus strain and age.
🟠 Strain-Specific Differences
The A(H3N2) subtype tends to wane more rapidly, with an estimated 7% monthly decline in effectiveness
🟠 Individual Variation
Immune response varies: about half of recipients show a modest antibody response, while others maintain strong and lasting immunity.
🟠 Recommended Timing
To ensure optimal protection, it is recommended to complete vaccination before the start of the influenza season, typically by late October.
This guidance is based on the latest recommendations from the American Academy of Pediatrics (AAP) and the Advisory Committee on Immunization Practices (ACIP).
文献(Click here for details)
1. Recommendations for Prevention and Control of Influenza in Children, 2023-2024. Pediatrics. 2023;152(4):e2023063773. doi:10.1542/peds.2023-063773.
2. Prevention and Control of Seasonal Influenza With Vaccines: Recommendations of the Advisory Committee on Immunization Practices - United States, 2024-25 Influenza Season. Grohskopf LA, Ferdinands JM, Blanton LH, Broder KR, Loehr J.
MMWR. Recommendations and Reports : Morbidity and Mortality Weekly Report. Recommendations and Reports. 2024;73(5):1-25. doi:10.15585/mmwr.rr7305a1.
3. High-Resolution Antibody Dynamics Following Influenza Vaccination Reveal Predominantly Weak Responses as Well as Infrequent but Durable Immunity Across the 2014-2022 Seasons. Lane A, Quach HQ, Ovsyannikova IG, et al.
Vaccine. 2025;:127677. doi:10.1016/j.vaccine.2025.127677.
4. Intraseason Waning of Influenza Vaccine Protection: Evidence From the US Influenza Vaccine Effectiveness Network, 2011-12 Through 2014-15. Ferdinands JM, Fry AM, Reynolds S, et al.
Clinical Infectious Diseases : An Official Publication of the Infectious Diseases Society of America. 2017;64(5):544-550. doi:10.1093/cid/ciw816.
Q: Side Effects and Management After Influenza HA Vaccination
A: Common reactions include redness, swelling, or pain at the injection site. These usually resolve within 2–3 days.
- Occasional systemic symptoms may include fever, fatigue, headache, chills, rash, or hives.
- If the injection site becomes warm or swollen, apply a cool towel or compress to relieve discomfort.
A firm lump may remain temporarily, but it typically resolves over time.
- If you experience fever, monitor your condition and consider using cooling methods or antipyretics such as acetaminophen.
If you notice unusual symptoms, please consult a healthcare provider promptly.
When Vaccination Should Be Deferred
Vaccination is not recommended for individuals who:
- Have a fever of 37.5°C or higher
- Are suffering from a severe acute illness
- Have a history of anaphylaxis caused by previous vaccines
- Developed fever or widespread rash within 2 days of a routine vaccination (excluding voluntary vaccines)
Mild reactions such as redness, swelling, or low-grade fever do not necessarily prevent future vaccination.
Please consult your physician to determine whether vaccination is appropriate.
Tips to Reduce Pain and Anxiety During Vaccination
To help ease discomfort and anxiety during vaccination, the following strategies are recommended:
- Avoid using language that may increase fear or anxiety, especially with children or anxious individuals.
- If you have a history of fainting or feeling unwell during injections, consider receiving the vaccine while lying down.
・- Administering the vaccine deeply into the subcutaneous tissue at a 60–90° angle may help reduce local reactions such as swelling.
Intramuscular injections are generally associated with fewer local side effects than subcutaneous injections.。
Reporting Suspected Adverse Reactions (Click to view)(Click here for details)
・インフルエンザHAワクチン接種後に副反応が疑われる場合、医療機関では国の定める基準に従って報告を行っています。報告内容は厚生労働省の専門部会で評価され、公開されています。
2023/2024シーズンでは、約5,400万回の接種のうち、医療機関からの報告は57例(うち重篤例34例、死亡例5例)でした。非常にまれなケースですが、万が一の際には適切な対応が取られています
ご不安な点がある場合は、接種前後に医師や看護師へ遠慮なくご相談ください。安全で安心な接種のために、皆さまのご理解とご協力をお願いいたします。
文献(Click here for details)
1)予防接種ガイドライン等検討委員会: インフルエンザ・肺炎球菌感染症(B類疾病)予防接種ガイドライン2023年度版. 公益財団法人予防接種リサーチセンター. 2023.
2)予防接種ガイドライン等検討委員会: 予防接種ガイドライン2024年度版. 公益財団法人予防接種リサーチセンター. 2024.
3)一般社団法人 日本ワクチン産業協会: ワクチンの基礎2023―ワクチン類の製造から流通まで. 2023.
4)日本薬学会: 薬学用語解説.
5)第101回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和6年度第1回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催). 資料2-26. 2024年4月15日. https://www.mhlw.go.jp/content/11120000/001244841.pdf(アクセス2024年4月16日現在)
6)国立感染症研究所: 「予防接種後副反応疑い報告書」入力アプリ. https://www.niid.go.jp/niid/ja/vaccine-j/6366-vaers-app.html(アクセス2024年3月29日現在)
7)厚生科学審議会予防接種・ワクチン分科会副反応検討部会. https://www.mhlw.go.jp/stf/shingi/shingi-kousei_284075.html(アクセス2024年3月29日現在)
8)厚生労働省: 予防接種法に基づく医師等の報告のお願い. https://www.mhlw.go.jp/bunya/kenkou/kekkaku-kansenshou20/hukuhannou_houkoku/(アクセス2024年3月29日現在)
Influenza and Tdap Vaccination During Pregnancy (Click to view)(Click here for details)
🟠Influenza Vaccine (Inactivated)
- The inactivated influenza vaccine is safe to administer at any stage of pregnancy.
- The Advisory Committee on Immunization Practices (ACIP)recommends vaccination during early, mid, or late pregnancy,as it plays a vital rolein preventing influenza-related complications in す。both the mother and the baby.
🟠 Tdap Vaccine (Tetanus, Diphtheria, Pertussis)
- The recommended timing for Tdap vaccination isbetween 27 and 36 weeks of pregnancy.
- Receiving the vaccine earlyin this window (around 27–30 weeks)allows for greater transfer of protective antibodies to the baby via the placenta, enhancing protection against pertussis (whooping cough) after birth.
- However, Tdap may be administered at any time during pregnancy if needed.
🟠 Why This Timing Matters
- These recommendations are based on scientific evidence showing that maximizing the maternal immune response and enhancing antibody transfer to the fetus provides passive immunity to the newborn.
- This is especially important during the early weeks after birth, when the baby is most vulnerable to infection but not yet eligible for direct vaccination.
引用文献(一部抜粋)
• Razzaghi H, et al. MMWR, 2020;69(39):1391-1397. doi:10.15585/mmwr.mm6939a2.
• Liang JL, et al. MMWR Recommendations and Reports, 2018;67(2):1-44. doi:10.15585/mmwr.rr6702a1.
• Healy CM, et al. JAMA, 2018;320(14):1464-1470. doi:10.1001/jama.2018.14298.
1)予防接種ガイドライン等検討委員会: インフルエンザ・肺炎球菌感染症(B類疾病)予防接種ガイドライン2023年度版. 公益財団法人予防接種リサーチセンター. 2023.
2)予防接種ガイドライン等検討委員会: 予防接種ガイドライン2024年度版. 公益財団法人予防接種リサーチセンター. 2024.
3)一般社団法人 日本ワクチン産業協会: ワクチンの基礎2023―ワクチン類の製造から流通まで. 2023.
4)日本薬学会: 薬学用語解説.
5)第101回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和6年度第1回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催). 資料2-26. 2024年4月15日. (アクセス2024年4月16日現在)
6)国立感染症研究所: 「予防接種後副反応疑い報告書」入力アプリ. (アクセス2024年3月29日現在)
7)厚生労働省: 予防接種法に基づく医師等の報告のお願い. アクセス2024年3月29日現在)
8)厚生科学審議会予防接種・ワクチン分科会副反応検討部会. アクセス2024年3月29日
Influenza HA Vaccination for Individuals with Allergies
🟠 Individuals with egg allergy or bronchial asthma are generally eligible for vaccination.
🟠 The influenza HA vaccine contains only trace amounts of egg-derived components (typically a few nanograms per milliliter).Therefore, it is considered safe for most people with egg allergy or asthma,and adverse reactions are extremely rare.between 27 and 36 weeks of pregnancy.
国内・米国の対応(予防接種ガイドラインより)(Click here for details)
• 接種不適当者:
ワクチン成分によるアナフィラキシーの既往がある方
• 接種要注意者:
鶏卵・鶏肉など鶏由来成分にアレルギーのある方
喘息などのアレルギー疾患がコントロール不良の場合
• 接種時の留意点:
接種前に体調を整え、問診でアレルギー歴を確認
接種後30分間の院内観察と緊急対応体制の整備が推奨されます
• 喘息患者への接種:
感染症による喘息悪化を防ぐため、インフルエンザワクチン接種は有用とされており、ステロイド治療中でも多くの場合接種可能です(詳細は医師にご相談ください)
米国の対応(ACIP勧告より)
• 卵アレルギーの有無にかかわらず、インフルエンザワクチン接種は推奨されています
• 追加の安全対策は不要とされ、通常の接種と同様に対応可能
接種後は15分間の観察が推奨されています(失神などのリスク軽減のため)
文献
1)予防接種ガイドライン等検討委員会: 予防接種ガイドライン2024年度版. 公益財団法人予防接種リサーチセンター. 2024.
2)Greenhawt M, et al.: Ann Allergy Asthma Immunol. 120(1): 49-52, 2018.
3)Nagao M, et al.: J Allergy Clin Immunol. 137(3): 861-867, 2016.
4)「喘息予防・管理ガイドライン2021」作成委員: 喘息予防・管理ガイドライン2021. 一般社団法人日本アレルギー学会 喘息ガイドライン専門部会 監修. 協和企画. 2021.
5)CDC: MMWR Recomm Rep. 60(RR-2): 1-60, 2011.
6)Vasileiou E, et al. : Clin Infect Dis. 65(8): 1388-1395, 2017.
7)GINA : Global strategy for asthma management and prevention. 2020.
8)Committee on Infectious Diseases: Recommendations for Prevention and Control of Influenza in children. 2019-2020. Pediatrics.144(4): e20192478, 2019.
妊婦・授乳婦・妊娠希望者へのインフルエンザHAワクチン接種について
接種の意義とメリット
• 妊婦はインフルエンザに感染すると重症化しやすく、心肺機能への負担や胎児への影響が懸念されます。
• 不活化インフルエンザHAワクチンは妊娠全期間を通じて安全性が高く、世界的に接種が推奨されています。
• 妊婦が接種することで、胎盤を介して胎児に抗体が移行し、生後6か月までの乳児を守る効果が期待されます。
• 授乳婦が接種することで、母体の感染予防が乳児への伝播防止につながると考えられています。
不妊治療中でも接種可能であり、妊娠成立後の胎児への影響はないとされています。
接種時期の目安
• ワクチンの効果は接種後約2週間から約5か月間持続します。
• 日本のインフルエンザ流行は1月〜3月が中心のため、接種は10月〜12月中旬が理想的between 27 and 36 weeks of pregnancy.
安全性と注意点
• 副反応としての発熱や腫れ、倦怠感などの症状は、妊娠の有無にかかわらず同じ頻度で発生しています。
• 流産や早産、奇形といったリスクが増加したとの報告はありません。
• 授乳中の方が接種しても、母乳を通じて乳児に悪影響が及ぶことはありません。
• たとえ乳児に卵アレルギーがあっても、授乳している母親への接種は原則として問題ありません
• 母親自身が卵アレルギーで鶏卵の摂取を控えている場合は、接種の可否を慎重に判断します。
保存剤(チメロサール)について
• 一部のワクチンには防腐剤としてチメロサール(エチル水銀)がごく微量含まれていますが、胎児への影響はないと考えられており、自閉症との関連性も否定されています。
• 妊婦へのワクチン接種では、可能であれば防腐剤無添加の製剤を選ぶことが望ましいとされています。
Q:帯状疱疹・おたふくかぜなどのウイルス性疾患罹患後のインフルエンザHAワクチンの接種時期、効果、注意点について。また、家族や周囲の人が罹患した場合の対応は
ウイルス性疾患罹患後のインフルエンザ不活化ワクチン接種接種時期の目安
• 軽症の場合
→ 症状回復後すぐに接種可能
• 中等症の場合
→ 治癒後約2週間程度あける
• 免疫低下する疾患(例:麻しん)
→ 治癒後4週間以降が目安
• 帯状疱疹の場合
→ 急性期を過ぎ回復傾向なら接種可能
家族・周囲の人が罹患した場合の対応
• 特におたふくかぜ後の無菌性髄膜炎や風しん後の血小板減少性紫斑病など合併症を誤解されないよう事前説明が重要
• 疾患の種類や流行状況に応じて判断
• 潜伏期間中の接種は副反応と誤認されやすいため慎重に行う
Influenza Vaccination After Recovering from Infection
General Recommendations (Japan)
- Vaccination remains effective even after a prior influenza infection.
- It is recommended to wait 1 to 2 weeks after full recovery before receiving the vaccine.
- During the influenza season, early vaccination after recovery is encouraged to maintain protection.
- Since influenza viruses include multiple subtypes, reinfection with a different strain is possible even after one episode.
🟠 U.S. CDC Guidance
- The Centers for Disease Control and Prevention (CDC) reports that vaccination during the recovery phase or incubation period does not reduce vaccine effectiveness or increase the risk of side effects.
- Vaccination is not contraindicated for individuals with mild acute illness, those recovering, or those receiving antibiotics.
- Even during hospitalization, patients with mild to moderate illness are generally eligible for vaccination.
- The Centers for Disease Control and Prevention (CDC) reports that vaccination during the recovery phase or incubation period does not reduce vaccine effectiveness or increase the risk of side effects
- Vaccination is not contraindicated for individuals with mild acute illness, those recovering, or those receiving antibiotics.
- Even during hospitalization, patients with mild to moderate illness are generally eligible for vaccination.
文献(Click here for details)
1)予防接種ガイドライン等検討委員会: 予防接種ガイドライン2024年度版. 公益財団法人予防接種リサーチセンター. 2024.
2)CDC: Contraindications and Precautions. General Best Practice Guidelines for Immunization. (アクセス2024年4月12日現在)
3)厚生労働省新型コロナウイルス感染症対策推進本部: 事務連絡. 新型コロナウイルス感染症の感染症法上の位置付け変更後の療養期間の考え方等について(令和5年5月8日以降の取扱いに関する事前の情報提供). 2023年4月14日. アクセス2024年3月29日現在)
Q:呼吸器、循環器、腎疾患、糖尿病などの基礎疾患を有する方や周術期にインフルエンザHAワクチンを接種する際に注意すべき点を教えてください。(Click here for details)
A: 1 基礎疾患を有する方はインフルエンザに罹患すると重症化しやすいためワクチン接種が強く推奨されます。
2 接種不適当者でなければおおむね安全に接種可能ですが基礎疾患や治療薬の影響と副反応の鑑別に注意が必要です。
3 慢性呼吸器疾患の患者では重篤な副反応はまれで喘息発作や間質性肺炎のリスクを踏まえて接種後の観察が必要です。
4 心血管疾患の患者は注射部位の痛みなどによる血圧変動や血管迷走神経反射に注意し抗凝固薬服用者は接種部位の出血にも配慮します。
5 インフルエンザワクチン接種は心血管イベントのリスクを低減するという報告もあります。
6 腎疾患患者特に透析患者は感染リスクや死亡率が高いため積極的な接種が推奨されます。
7 肝疾患患者は病状が安定していれば接種可能で血小板減少があれば注射部位出血に注意します。
8 自己免疫疾患患者や免疫抑制状態の患者は免疫応答がやや低下しますが安全性は報告されています。
9 脳血管障害や中枢神経疾患の患者はワクチン副反応との鑑別に注意が必要でてんかん患者は病状安定時に接種し発作予防策の説明が重要です。
10 糖尿病患者はやや効果が低いものの有効で入院や死亡リスクの低減に寄与し毎年の接種が推奨されます。
11 周術期の接種は症状判別が難しいため原則避けますが個別に検討し臓器移植患者は状態に応じて接種時期を決定します。
12 COVID-19罹患後は症状が軽快し感染性がなくなれば接種可能で同時接種も問題ありません。
13 医療機関外での接種は安全管理が整っていれば自宅等でも可能で免疫低下患者は十分な問診と観察が重要です。
14 これらを踏まえ適切な管理のもとで基礎疾患患者のインフルエンザHAワクチン接種は重要な感染予防策となります。
文献(Click here for details)
1)厚生労働省: 令和5年度インフルエンザQ&A. (アクセス2024年4月9日現在)
2)CDC: Who Should and Who Should NOT get a Flu Vaccine. アクセス2024年4月9日現在)
3)第101回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和6年度第1回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催). 資料2-26. 2024年4月15日. (アクセス2024年4月16日現在)
4)Pesek R, et al.: Allergy. 66(1): 25-31, 2011.
5)Udell JA, et al.: JAMA. 310(16): 1711-1720, 2013.
6)日本腎臓学会: エビデンスに基づくCKD診療ガイドライン 2023. 2023年6月.
7)日本透析医会: 透析施設における標準的な透析操作と感染予防に関するガイドライン(六訂版). 2023年12月.
8)Song JY, et al.: J Clin Virol. 39(3): 159-163, 2007.
9)Huang Y, et al.: Curr Med Res Opin. 33(10): 1901-1908, 2017.
10)Westra J, et al.: Nat Rev Rheumatol. 11(3): 135-145, 2015.
11)Lu CC, et al.: Vaccine. 29(3): 444-450, 2011.
12)日本エイズ学会: HIV感染者のためのワクチンガイドライン. 2023年7月.
13)日本小児感染症学会 監修: 免疫不全状態にある患者に対する予防接種ガイドライン2024. 2024年.
14)予防接種ガイドライン等検討委員会: 予防接種ガイドライン2024年度版. 公益財団法人予防接種リサーチセンター . 2024.
15)Casper C, et al.: Blood. 115(7): 1331-1342, 2010.
16)Lau D, et al.: Thorax. 68(7): 658-663, 2013.
17)Vamos EP, et al.: CMAJ. 188(14): E342-E351, 2016.
18)日本糖尿病学会 編・著: 糖尿病診療ガイドライン2019. 南江堂, 2019.
19)岡部信彦, 多屋馨子, 神谷 元:予防接種に関するQ&A集2023. Q9 p.46-47, 一般社団法人日本ワクチン産業協会. 2023.
20)日本造血・免疫細胞療法学会: 造血細胞移植ガイドライン 予防接種(第4版). 2023年12月.
21)Tartof SY, et al.: Ann Intern Med. 164(9): 593-599, 2016.
22)一般社団法人日本呼吸器学会 COVID-19 FAQ広場. (アクセス2024年4月9日現在)
23)日本小児科学会・日本小児感染症学会・日本外来小児科学会 小児COVID-19合同学会ワーキンググループ: 小児の外来診療におけるコロナウイルス感染症2019(COVID-19)診療指針 第2版. 2021年9月29日.
24)厚生労働省: 新型コロナワクチンQ&A. (アクセス2024年4月9日現在)
25)厚生労働省: 定期接種実施要領.
26)厚生労働省通知: 医政発0331第68号, 健発0331第28号. 2015年3月31日.
27)Caldera F, et al.: Vaccine. 39: A15-A23, 2021.
Q: What is the effectiveness of influenza vaccination in healthy adults under the age of 65? (Click to view)(Click here for details)
A: インフルエンザHAワクチンの効果について
• インフルエンザHAワクチンは、65歳未満の健康な成人に対して比較的高い予防効果が認められており、接種が推奨されています。
• ワクチン株と流行株の型が一致した場合、約60%の発症予防効果が期待されます。
• これは、重症化リスクのある方を介護する人や医療従事者にとって特に重要です。
• ただし、インフルエンザウイルスは毎年変異するため、ワクチン株と流行株の抗原性が一致しない場合は効果が低下します。
それでも、ワクチン接種により重症化や入院のリスクを軽減できることが多く、生後6カ月以上のすべての適格者に毎年の接種が推奨されています。
文献 1)厚生労働省令和5年度インフルエンザQ&A (2024年4月4日閲覧)
2)Demicheli V, et al.: Cochrane Database Syst Rev. 2(2):1-255,2018
3)CDC: Who needs a flu vaccine (2024年4月4日閲覧)
4)CDC: CDC seasonal flu vaccine effectiveness studies (2024年4月4日閲覧)
5)厚生労働省高齢者介護施設感染対策マニュアル改訂版2019 (2024年4月4日閲覧)
6)こども家庭庁保育所感染症対策ガイドライン2018 (2024年4月4日閲覧)
7)Baumgartner EA, et al.: J Infect Dis.206(6):838-846,2012 8)予防接種ガイドライン等検討委員会インフルエンザ・肺炎球菌感染症予防接種ガイドライン2023年度版2023
9)CDC: Guidance for Cruise Ships on Influenza-like Illness (ILI) Management
10)WHO: Influenza surveillance outputs (2024年5月13日閲覧)
11)国立感染症研究所インフルエンザ患者発生状況 (2024年5月13日閲覧)
12)日本政府観光局JNTO年別訪日外客数 (2024年5月13日閲覧)
13)日本ワクチン学会2022-23シーズンの季節性インフルエンザワクチン接種に関する見解 (2024年4月4日閲覧)
🧬インフルエンザ経鼻生ワクチンフルミスト®について
フルミスト®(生ワクチン:LAIV)の接種対象者と禁忌について
※特に喘息、喘鳴の既往、アレルギー性鼻炎、食物アレルギーのある小児に関する注意点
接種対象者:
• 年齢が2歳以上〜18歳まで(19歳未満)
• 健康状態は重度の喘息や免疫不全がない方
• 妊娠していない方(妊婦や妊娠の可能性がある方は対象外)
接種に注意が必要な方
• 鼻炎や鼻づまりが強い方(効果が減弱する可能性あり)
• ゼラチンアレルギーがある方
• 免疫抑制治療中または免疫不全のある方
• 妊娠中または妊娠の可能性がある方
• 重度の喘息で最近発作を起こした方
• アスピリン服用中の川崎病患者
• 重度の免疫不全者と日常的に接する方
• 米国ではフルミスト®は、2歳以上49歳以下の健康な非妊娠者に対して承認されておりますが、日本では2歳以上18歳以下(19歳未満)の方です
禁忌:
以下の条件に該当する小児にはフルミスト®を接種できません
• 2歳未満の小児(入院や喘鳴のリスクが高いため)
• 2〜4歳で過去12か月以内に喘鳴や喘息の既往がある小児
• 重度の喘息または現在喘鳴がある小児
• 過去のインフルエンザワクチンまたはフルミストの成分に対してアナフィラキシーなどの重度のアレルギー反応を起こしたことがある小児
• ゼラチンに対するアレルギーがある小児(年齢に応じて不活化ワクチンまたは組換えワクチンを使用)
• 妊娠中の小児(妊娠判明時)
• 重度の免疫不全者の近親者や介護者
• 最近インフルエンザ抗ウイルス薬を服用した小児(一定期間は接種不可)
注意事項:
• 5歳以上の喘息や慢性疾患(肺・心臓・腎臓・肝臓・神経・血液・代謝疾患など)を持つ小児には、フルミスト®よりも不活化インフルエンザワクチンの方が一般的に推奨されます。
• ギラン・バレー症候群の既往がある場合(前回のインフルエンザワクチン接種から6週間以内)は、すべてのインフルエンザワクチンに注意が必要です。
• 中等度〜重度の急性疾患(COVID-19含む)がある場合は、症状が改善するまで接種を延期します。軽度の症状は禁忌ではありません。
アレルギー性鼻炎や軽度の上気道症状がある小児は、フルミスト®接種による有害事象のリスクは高くなく、禁忌ではありません。
• 食物アレルギー(卵アレルギーを含む)がある小児も、フルミスト®を含むすべてのインフルエンザワクチンを安全に接種できます。
• 重度の卵アレルギー(アナフィラキシー)のある場合は医療管理下での接種が推奨されますが、全体としてリスクは高くありません。
🔺抗インフルエンザ薬服用前後のフルミスト接種について
• インフルエンザの生ワクチン型ワクチン(フルミスト)を接種する際、抗インフルエンザ薬の服用歴によって接種を控える期間が異なります。
• オセルタミビル(タミフル)やザナミビル(リレンザ)を使った場合は最終投与から48時間、
ペラミビル(ラピアクタ)では5日間、
バロキサビル マルボキシル(ゾフルーザ)では17日間あける必要があります。
• これらの期間内に接種すると、抗ウイルス薬がワクチンウイルスの増殖を妨げ、ワクチンの効果が弱まる恐れがあるためです。
腎機能障害などで薬の排出が遅れる場合は、さらに間隔を延長することが推奨されます。
• 接種前に抗ウイルス薬を服用している場合は、上記の期間を十分にあけてからフルミスト®を受けてください。
• 接種後2週間以内に抗ウイルス薬を使用した場合も効果が十分に得られない可能性があるため、不活化インフルエンザワクチン(注射タイプ)での再接種が推奨されます。
• フルミスト®は生ワクチンで、体内でウイルスが増殖することで免疫を獲得しますが、抗ウイルス薬が増殖を妨げるため、服用期間中や接種後2週間以内の抗ウイルス薬使用はワクチン効果を低減させる可能性があります。
• 不活化ワクチンはウイルスの増殖を伴わないため抗ウイルス薬の影響を受けず、確実な免疫効果が期待できます。再接種のタイミングは医師と相談し、体調や薬の状況に応じて決めてください。
※これらは薬の体内での作用時間や排泄速度に基づいて設定されています。腎機能障害などがある場合は期間が長くなることがあります。
• 接種後インフルエンザ迅速診断(抗原検出法)で陽性となる期間について
フルミスト®接種後、インフルエンザ迅速診断(抗原検出法)で陽性となる可能性がある期間は、主に接種後7日以内です。 健康成人を対象とした研究では、フルミスト接種者の約50%が接種後7日以内にDFA(直接蛍光抗体法)で、約14%がEIA(酵素免疫測定法)で陽性となりましたが、12日以降に陽性となった例は認められていません。
• ワクチン由来ウイルスの排出は主に接種後1週間以内ですが、健常者や妊婦・乳幼児への感染リスクは極めて低く、通常の生活・登園に制限はありません。重度免疫不全者との接触のみ注意が必要です。この点は米国の最新ガイドライン(FDA承認、ACIP/AAP勧告)に基づくものです
文献(Click here for details)
1. Recommendations for Prevention and Control of Influenza in Children, 2023-2024. Pediatrics. 2023;152(4):e2023063773. doi:10.1542/peds.2023-063773.
2. Recommendations for Prevention and Control of Influenza in Children, 2022-2023. Pediatrics. 2022;150(4):e2022059275. doi:10.1542/peds.2022-059275.
3. Recommendations for Prevention and Control of Influenza in Children, 2024-2025: Policy Statement. Pediatrics. 2024;154(4):e2024068507. doi:10.1542/peds.2024-068507.
4. Recommendations for Prevention and Control of Influenza in Children, 2019-2020. Pediatrics. 2019;144(4):e20192478. doi:10.1542/peds.2019-2478.
5. Safety of Live Attenuated Influenza Vaccine in Young People With Egg Allergy: Multicentre Prospective Cohort Study. Turner PJ, Southern J, Andrews NJ, Miller E, Erlewyn-Lajeunesse M.
6. Safety of Live Attenuated Influenza Vaccine in Atopic Children With Egg Allergy. Turner PJ, Southern J, Andrews NJ, Miller E, Erlewyn-Lajeunesse M. The Journal of Allergy and Clinical Immunology. 2015;136(2):376-81. doi:10.1016/j.jaci.2014.12.1925.
7. Administration of Influenza Vaccines to Egg Allergic Recipients: A Practice Parameter Update 2017. Greenhawt M, Turner PJ, Kelso JM.
8.Annals of Allergy, Asthma & Immunology : Official Publication of the American College of Allergy, Asthma, & Immunology. 2018;120(1):49-52. doi:10.1016/j.anai.2017.10.020.
9. The Adverse Reactions to Vaccines Practice Parameter 10 Years on-What Have We Learned?. Kelso JM. Annals of Allergy, Asthma & Immunology : Official Publication of the American College of Allergy, Asthma, & Immunology. 2022;129(1):35-39. doi:10.1016/j.anai.2022.01.026.1.
10.Prevention and Control of Seasonal Influenza With Vaccines: Recommendations of the Advisory Committee on Immunization Practices - United States, 2022-23 Influenza Season. Grohskopf LA, Blanton LH, Ferdinands JM, et al.
11.MMWR. Recommendations and Reports : Morbidity and Mortality Weekly Report. Recommendations and Reports. 2022;71(1):1-28. doi:10.15585/mmwr.rr7101a1. Copyright License: CC0
12. Recommendations for Prevention and Control of Influenza in Children, 2024-2025: Policy Statement.Pediatrics. 2024;154(4):e2024068507. doi:10.1542/peds.2024-068507.
13. Recommendations for Prevention and Control of Influenza in Children, 2023-2024. Pediatrics. 2023;152(4):e2023063772. doi:10.1542/peds.2023-063772.
14. Prevention and Control of Seasonal Influenza With Vaccines: Recommendations of the Advisory Committee on Immunization Practices - United States, 2024-25 Influenza Season.Grohskopf LA, Ferdinands JM, Blanton LH, Broder KR, Loehr J.
15. MMWR. Recommendations and Reports : Morbidity and Mortality Weekly Report. Recommendations and Reports. 2024;73(5):1-25. doi:10.15585/mmwr.rr7305a1.
16. Detection of Influenza Antigen With Rapid Antibody-Based Tests After Intranasal Influenza Vaccination (FluMist).Ali T, Scott N, Kallas W, et al.
Clinical Infectious Diseases : An Official Publication of the Infectious Diseases Society of America. 2004;38(5):760-2. doi:10.1086/382887.
17. Flumist. FDA Drug Label. Food and Drug Administration (DailyMed).
18. Recommendations for Prevention and Control of Influenza in Children, 2024-2025: Policy Statement. Pediatrics. 2024;154(4):e2024068507. doi:10.1542/peds.2024-068507. Practice Guideline
19. Prevention and Control of Seasonal Influenza With Vaccines: Recommendations of the Advisory Committee on Immunization Practices - United States, 2024-25 Influenza Season. Grohskopf LA, Ferdinands JM, Blanton LH, Broder KR, Loehr J.
20 MMWR. Recommendations and Reports : Morbidity and Mortality Weekly Report. Recommendations and Reports. 2024;73(5):1-25. doi:10.15585/mmwr.rr7305a1. Practice Guideline20
21. Recommendations for Prevention and Control of Influenza in Children, 2023-2024. Pediatrics. 2023;152(4):e2023063772. doi:10.1542/peds.2023-063772.Pediatrics. 2023;152(4):e2023063773. doi:10.1542/peds.2023-063773.
